
死亡域蛋白 ● FADD ● Mort1
发表时间:2022-09-16FADD又名Mort1,它是一种死亡域蛋白,与Fas胞浆区呈特异性结合,故名Fas相关死亡域蛋白(Fas-associated with death domain protein)。FADD是一种25 kDa的接头蛋白,当Fas 与相应配体FasL (CD95L) 结合后,Fas 受体三聚化而活化,激活的受体与FADD结合,再与caspase-8 相互作用使后者激活,形成死亡诱导信号复合物,再激活一系列的Caspase-1, 3, 7等,促进Fas蛋白所在细胞的凋亡发生。如下图所示:
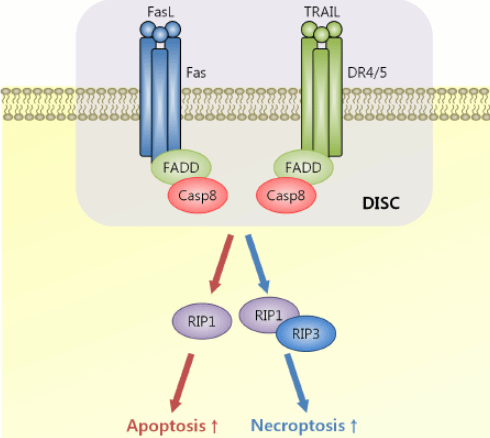
不同刺激引起的程序性坏死中FADD的作用如下图:
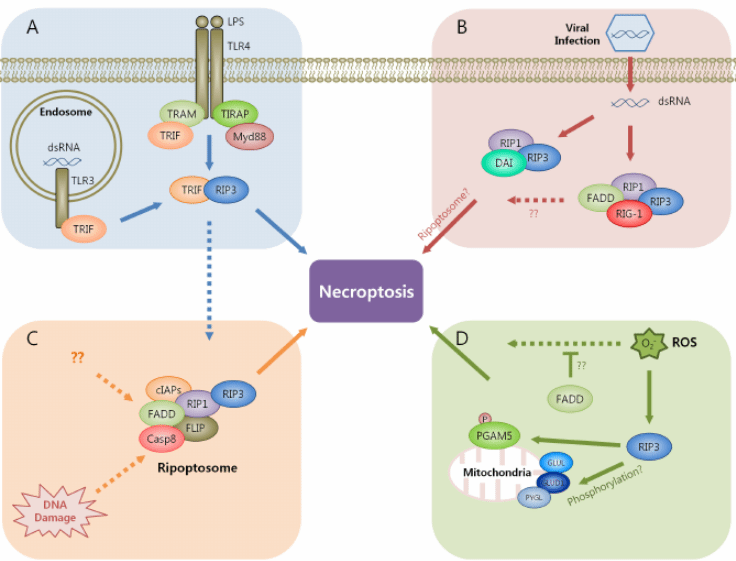
研究证实FADD参与多种疾病的发生发展,包括病毒感染、细菌感染、心血管疾病、缺血性损伤、动脉粥样硬化、慢性肠炎、胰腺炎、肝脏损伤等。
研究发现,FADD除了参与调节PKC的功能,也参与了多种非凋亡有关的细胞内进程。
一般来说,新合成的PKC一般需要经历活化茎环(Activation-loop,A-loop)、转角模体(Turn motif,TM)以及疏水模体(hydrophobic motif,HM)的程序性磷酸化过程才能成熟,获得进一步活化的功能。在这项研究里,南京大学华子春教授课题组发现,FADD参与调节了的失活。相关研究成果于5月11日发表在The Journal of Biological Chemistry上。
在研究过程中,一种FADD的磷酰基模拟的突变(S191D),促进了TM及HM的脱磷酸化,这表明S191的磷酸化作用负调节了FADD。
PP2A是一种与cPKC脱磷酸化有关的主要的磷酸酶。研究发现,FADD能与PP2A相互作用,而且FADD的缺陷破坏了PP2A介导的cPKC的脱磷酸化作用。
进一步研究表明,FADD缺陷导致了cPKC稳定性及活性增强,反过来促进了重构、运动及趋化性。
总的来说,这些结果表明了FADD一种新的功能:在非凋亡过程中,FADD能够调节cPKC的去磷酸化、稳定性及信号终止。

●【FNab02941】
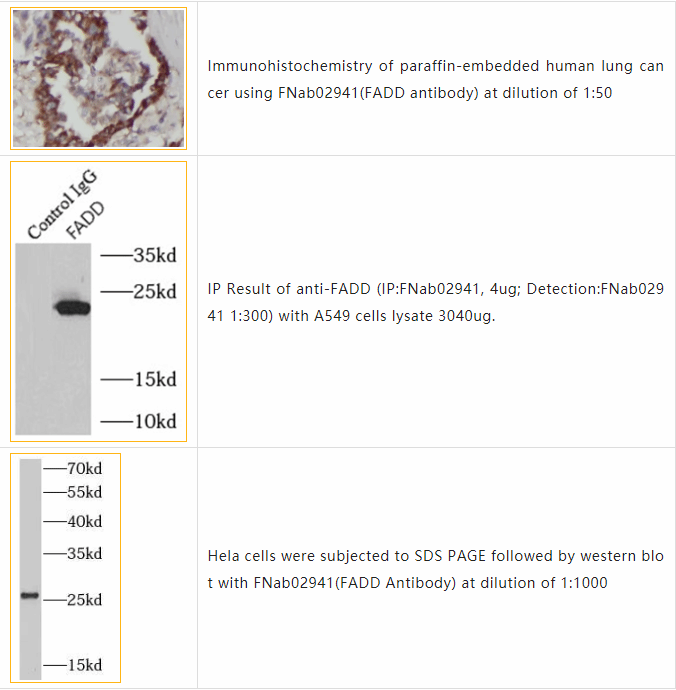
被引用文献如下

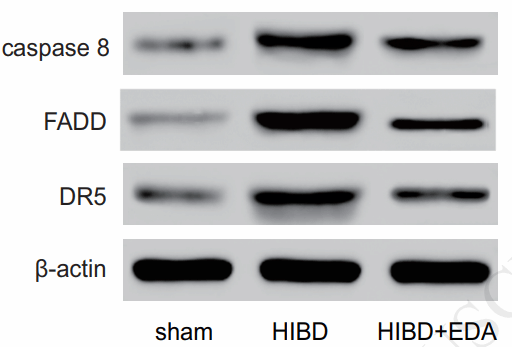
Western blot检测DR5、FADD、caspase 8、Bcl-2和Bax的表达水平。样本为7日龄Sprague-Dawley新生大鼠脑组织,分为假手术组(sham)、 缺氧缺血性脑损伤组(HIBD)和注射依达拉奉的HIBD组(HIBD+EDA)。依达拉奉是一种脑保护剂(自由基清除剂)。
js33333金沙线路检测/抗体
抗体:可以提供兔多抗、鼠单抗10000余种,
验证实验有:ELISA,WB,IHC,IF,IP等;
100余种标记二抗,HRP、AP、Biotin、FITC、Alexa Fluor 488、CY3、荧光素等标记物,每年新增研发抗体近千种。
END

 联系我们
CONTACT
联系我们
CONTACT




